Jaunā pasaule – dzīvošana un dzīvību glābšana
Bija paredzēts, ka no 2020. gada 26. maija Eiropas Savienībā tiks piemērota Medicīnisko ierīču regula (MDR). COVID-19 dēļ tā tika atlikta par vienu gadu.
Tomēr pēc gadiem ilgām diskusijām jaunā sistēma drīz kļūs par realitāti. Un ražotājiem, valsts aģentūrām, pārvaldes iestādēm un patērētājiem tai būs jāpakļaujas. Kur mēs atrodamies? Vai MDR palielina pacientu drošību? Vai arī nozares novatoriskais spēks ir vājināts? Un: ko mēs tagad darīsim? Ekskluzīva B. Braun aptauja visos veselības aprūpes sistēmas līmeņos: viena reforma. Septiņas stacijas. Septiņi viedokļi.
1. stacija: Ideja
Andreass Švābs ir Eiropas Parlamenta deputāts kopš 2004. gada. Un CDU politiķis ar MDR ir nodarbojies gandrīz visu laiku. "Spiediens uz politiķiem bija milzīgs," stāsta Švābs, "un atspoguļojums plašsaziņas līdzekļos bija diezgan neobjektīvs. Tas ir apgrūtinājis mūsu darbu.” MDR tika pieņemta 2017. gada maijā. Paredzams, ka trīs gadu pārejas periods pirmajām ierīču klasēm beigsies. Bet Andreass Švābs zina, ka darbs ar šo tēmu viņam aizņems vēl ilgu laiku.
„2010. gadā defektīvi krūšu implanti no ražotāja Poly Implant Prothèse izraisīja ažiotāžu Francijā. Tas, kā šis uzņēmums veica uzņēmējdarbību, neatbilda noteikumiem, pat ņemot vērā tā laika kontekstu. Tomēr tā dēvētais PiP skandāls skaidri parādīja, ka trūkst efektīvas kontroles. Tagad pirmo reizi MDR nosaka vienotu noteikumu piemērošanu Eiropā. Ir arī nepieteiktas pārbaudes. Tas uzlabo pacientu drošību. Es pārņēmu atzinuma paziņojumu par MDR no franču kolēģa Eiropas Parlamenta Iekšējā tirgus un patērētāju aizsardzības komitejā – es daudz runāju ar sava vēlēšanu apgabala uzņēmumiem un zinātniekiem un uzaicināju Komisiju uz Vācijas dienvidrietumiem. Tātad, es ļoti labi varu saprast, ka daži ražotāji sūdzas, jo viņiem jāpierāda esošo ierīču efektivitāte un drošība. Pat ja problēmas ir bijušas tikai ar dažām melnajām avīm. Mums ir jānodrošina, ka visi produkti atbilst vismodernākajiem standartiem, lai garantētu vislabāko iespējamo pacientu drošību. Pirms kāda laika es paudu bažas, ka Eiropas Parlaments ir pārāk vērienīgs attiecībā uz īstenošanas termiņiem. Bet tas kopš tā laika ir uzlabojies. MDR ieviešanai ir nepieciešams sakārtotības un ātruma apvienojums.“
2. stacija: Stratēģija
2019. gada beigās Eiropas Komisija atlika termiņus, līdz kuriem saskaņā ar jauno regulu ir jāsertificē tā dēvētās 1R klases ierīces, piemēram, atkārtoti lietojami ķirurģiskie instrumenti. Bet vai tas palīdz ražotājiem? B. Braun Aesculap nodaļa ražo medicīnas ierīces Tutlingenā kopš 1867. gada. B. Braun valdes loceklis dr. Joahims Šulcs skaidro, kāpēc nav iespējams atgriezties.
„MDR sniedz pacientiem skaidras priekšrocības: piemēram, es domāju, ka ir taisnība, ka ražotāji vairs nevar paļauties tikai uz līdzvērtības principu, apstiprinot III klases ierīces, piemēram, implantus, viņiem jāveic jauni klīniskie pētījumi. Tomēr, ja mums jāpierāda, ka ķirurģisko šķēru dizainu, no kuriem dažus mēs ražojam un piegādājam vairāk nekā 100 gadus, var sterilizēt, izmantojot sterilizāciju ar tvaiku, tiek piesaistīti nevajadzīgi resursi un samazinās mūsu novatoriskais spēks. MDR ir radījusi jaunu pasauli. 50 līdz 60 procenti mūsu darbinieku attīstības un regulatīvo lietu nodaļās pašlaik nodarbojas ar esošo ierīču dokumentācijas uzturēšanu. Kā lielam uzņēmumam B. Braun vismaz ir iespēja veikt daudzus testus, kas tagad ir nepieciešami, uzņēmuma iekšienē. Un mēs nedomājam gulēt uz lauriem, tā vietā mēs raugāmies nākotnē. Tehnoloģijas strauji mainās: attīstībai, piemēram, efektīvām virsmām, kas novērš iekaisumu, vai operāciju zāles robotizācijai, ir milzīgs potenciāls. Godīgi sakot, mēs drīzāk gribētu izgudrot revolucionāras ierīces, nevis uzturēt dokumentu mapes.“
3. stacija: Uz testu galda
MDR maina ne tikai medicīnas ierīču ražotāju biznesu: arī visas pilnvarotās iestādes zaudēs savu lomu saskaņā ar veco ES MD direktīvu. Lai arī 2012. gadā visā Eiropā joprojām bija 83 pilnvarotās iestādes, pašlaik to ir tikai desmit. Un šo skaitli nevar pēkšņi palielināt, jo pieteikšanās process aizņem pusotru gadu, kā skaidro dr. Basils Akra, Minhenes TÜV SÜD globālās stratēģiskās biznesa attīstības viceprezidents.
„Kopš 2015. gada TÜV SÜD mēs katru gadu esam palielinājuši savu jaudu par 20 procentiem. Neraugoties uz to, mēs nevaram uzreiz apstrādāt visus ražotāju pieprasījumus pēc MDR sertifikācijas. Tomēr es šobrīd neredzu ārkārtas situāciju medicīnisko ierīču pieejamībai, jo lielākā daļa ražotāju līdz šim ir koncentrējušies uz savu ierīču sertifikātu pagarināšanu līdz 2024. gadam. Tātad faktiskais MDR darbs mums vēl ir priekšā. Principā es domāju, ka pastiprinātai uzraudzībai un tiesiskās situācijas saskaņošanai, ko nosaka MDR, ir liela jēga. Tomēr 175 lappušu garajā regulā ir daudz neskaidrību, un tas atstāj daudz interpretācijas iespēju. Piemēram, tajā teikts, ka pilnvarotajām iestādēm jānodrošina “pietiekamas uzraudzības sistēmas”. Bet ko patiesībā nozīmē “pietiekams”? Līdz šim ir publicēti 32 vadlīniju dokumenti, ar kuriem Eiropas Komisija plāno precizēt savu nostāju. Vēl 30 sekos līdz 2020. gada maijam. Un tad, protams, mums jāatzīst, ka 100% saskaņošana Eiropā nekad netiks panākta. Dalībvalstu valodas, kultūra un juridiskās tradīcijas vienkārši ir pārāk atšķirīgas. Piemēram, ja regulā ir noteikts, ka pilnvaroto iestāžu pētniekiem ir jābūt “klīniskai pieredzei”, tad Vācijā mēs to saprotam kā ārstu ar speciālista kvalifikāciju. Citās valstīs eksaminētājiem pietiek ar medmāsas bakalaura grādu vai, burtiski izsakoties, vienkārši strādāt klīnikā. Jums tas var nepatikt. Bet tā ir daļa no daudzveidības mūsdienu apvienotajā Eiropā.“
4. stacija: Iekšējie procesi
Tikai B. Braun slimnīcu aprūpes nodaļa atrodas 40 vietās. Medicīniskās ierīces tiek ražotas 18 no tām. Kvalitātes un vides vadības vecākais viceprezidents Jirgens Heils skaidro, kā MDR maina sarežģītus ražošanas procesus.
„Uz tukšas papīra lapas mēs pilnībā no jauna sastādījām klīniku, izstrādes, ražošanas un dzīves cikla vadības kvalitātes procesus un tehnisko dokumentāciju. Tas bija milzīgs projekts, kurā tikai mūsu slimnīcu aprūpes nodaļā vien vairākus gadus tika nodarbināti vairāk nekā 100 visu funkciju eksperti: kvalitātes vadības, normatīvo jautājumu, attīstības, ražošanas, medicīnas zinātnisko jautājumu, juridisko, IT, mārketinga un pārdošanas jomu. MDR izvirza tik daudz jaunu prasību, ka mums vajadzēja pārskatīt visus mūsu ārējos un iekšējos procesus un vajadzības gadījumā tos reorganizēt. Dažus uzdevumus mēs varējām paveikt ļoti ātri: piemēram, kvalitātes vadības sertifikātu saskaņā ar jaunāko standartu (ISO 13485: 2016) 2018. gada beigās. Viens darbs, kas mūs joprojām nodarbina, ir tas, ka katram izstrādājumam papildus medicīniskās ierīces etiķetei jābūt arī unikālam ierīces identifikācijas kodam, kas tiek uzrādīts Eiropas datu bāzē (EUDAMED). Taču šī datubāze tuvākajā nākotnē nebūs pieejama. Vairāk nekā 140 produktu grupām, piemēram, IV komplektiem vai intravenoziem katetriem, mums bija jāizveido tehniskā dokumentācija un apstiprināšanas pierādījumi un jādara tie pieejami datu bāzē saskaņā ar standartizētu procedūru. Runa iet par līdz pat 140 dokumentiem vienai ierīcei. Bet, tā kā mēs intensīvi strādājam pie šīs tēmas kopš 2016. gada beigām – piemēram, pirms gada ieplānojām resursus mūsu pilnvarotajā iestādē, – mēs veiksmīgi pabeidzām MDR auditu pagājušajā gadā septembrī. Mēs atrodamies labā pozīcijā un varam nomierināt klientus, kuri ar mums sazinās ar jautājumiem par pieejamību un sertifikāciju. Tomēr mums no piedāvājuma bija jāizņem dažas ierīces un komplekti. Piemēram, attiecībā uz ārēju ražotāju produktiem saskaņā ar jauno regulu mums jāpierāda, ka mums ir piekļuve viņu tehniskajai dokumentācijai, kas bieži vien vispār nav atļauta.“
5. stacija: Tirgus
Iepirkumu apvienība "Prospitalia" pārstāv vairāk nekā 1000 medicīnas iestādes, kuru ikgadējais iepirkumu apjoms ir 1,7 miljardi eiro. Lai mazinātu nenoteiktību klīnikās, aptiekās un veco ļaužu pansionātos, uzņēmums jau 2019. gadā veica plašu visu medicīnas ierīču piegādātāju aptauju. Viens no secinājumiem bija tāds, ka gandrīz divas trešdaļas ražotāju jau strādā ar MDR akreditētu pilnvaroto iestādi. Šeit Katja Vinkelsa Zur Strassena, Prospitalia biznesa konsultante, stāsta, kā novērtēt šo situāciju.
„Pasaules gals 2020. gada 26. maijā neiestāsies. ES Komisija to ir nodrošinājusi, pagarinot pārejas periodu lielākajai daļai medicīnas ierīču. Bet arī pēc tam, kā mēs esam noskaidrojuši, nav iemesla trauksmei. Tomēr tikai pirms gada daudzi no mūsu kontaktiem slimnīcu un piegādātāju pusē nebija labi informēti par MDR. Daudzi nezināja, piemēram, vai produktus, kas jau tika uzglabāti klīnikās, joprojām varēs izmantot, kad beigsies CE termiņš. Vai ir jēga veidot vienreizlietojamo izstrādājumu, piemēram, katetru, uzkrājumus. Atbilde: jā, jo, tiklīdz produkts nonāk slimnīcā un tādējādi ir pieejams lietotājam, tas tiek uzskatīts par “nodotu ekspluatācijā”. Ir īpaši gadījumi, kad produktus, īpaši lielas ierīces, montē tikai uz vietas un nodošana ekspluatācijā notiek tikai tad, kad montāža ir pabeigta. Kā iepirkumu asociācija mēs atrodamies starp ražotājiem un patērētājiem, tāpēc mums ir sava veida turniketa funkcija. Lai tirgū būtu lielāka pārredzamība, mēs 2019. gada vasarā veicām aptauju un nosūtījām to 180 ražotājiem, kas ir mūsu piegādātāji: 64 procenti, mērot pēc saistīto iestāžu iepirkumu apjoma, strādāja ar pilnvarotajām iestādēm, kuras jau ir MDR akreditētas. Un vismaz astoņi procenti plāno izņemt savas ierīces no tirgus. Mēs arī pieņemam, ka notiks tirgus konsolidācija. Tomēr tam var būt jēga. Piemēram, daži ārsti ieraduma dēļ strādā ar novecojušām ierīcēm, lai gan ir arī jaunākas alternatīvas, kuras pacienti panes labāk: piemēram, smagsvara un smalkas porozitātes trūces siets izraisa svešķermeņu reakcijas biežāk nekā mūsdienu ierīces. Attiecībā uz absolūtām nišas ierīcēm, piemēram, bērnu aprūpes ierīcēm, likumdevējam ir iespējams nodrošināt pieejamību, izmantojot valsts atbrīvojumu. Aizraujošs jautājums būs par to, kā attīstīsies izmaksas. Saskaņā ar mūsu aptauju, diez vai kāds ražotājs plāno paaugstināt cenas. Taču MDR dubultos sertifikācijas izmaksas.“
6. stacija: Vidēja lieluma uzņēmumi
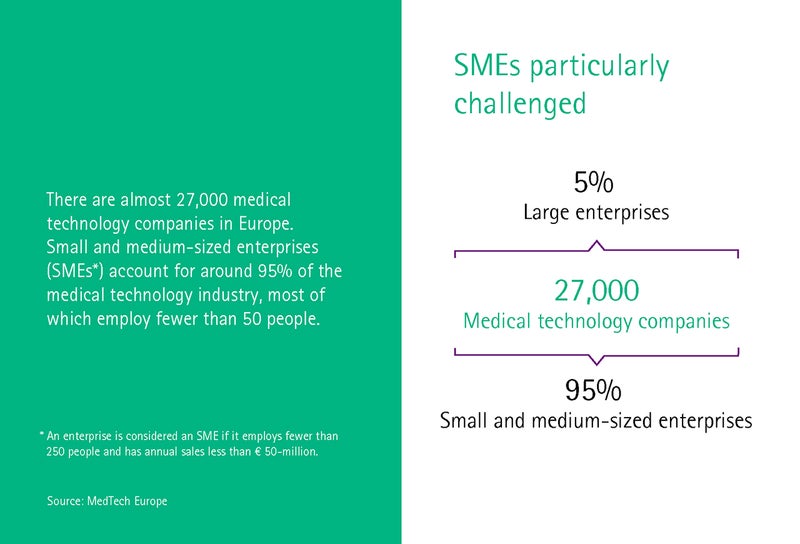
Medicīnas tehnoloģiju nozari Vācijā raksturo vidēji uzņēmumi. 93 procentos uzņēmumu ir mazāk nekā 250 darbinieku, savukārt 30 procentos ir mazāk nekā desmit darbinieku. Medicīnas tehnoloģiju klasteris Medical Mountains no Tutlingenas strādā ar daudziem šiem mazajiem un jaunizveidotajiem uzņēmumiem un palīdz viņiem sagatavoties MDR, kā ziņo klastera rīkotājdirektore Ivonna Glienke.
„Ja šodien kā regulatoru lietu eksperts dodaties Tutlingenas ielās, jūs nevarat izvairīties no darba piedāvājumu saņemšanas. Mazajiem ražotājiem jo īpaši ir problēmas piesaistīt viņiem nepieciešamos kvalificētos darbiniekus. Klasterī Medical Mountains 2019. gadā mēs organizējām kopumā 94 seminārus, kuros piedalījās vairāk nekā 1000 dalībnieku. Galvenā uzmanība tika pievērsta tādām tēmām kā kvalitātes vadība un sertifikāti. MDR noved pie tirgus konsolidācijas. Jo īpaši mazie uzņēmumi arvien biežāk saka “nē” jautājumam par to, vai pūles ir lietderīgas – tie apvieno spēkus, pārdod vai maina savu uzņēmējdarbības modeli un darbojas kā paplašināts darbagalds lielākajiem klientiem. Mēs esam bijuši saistīti ar MDR vairāk nekā desmit gadus, esam runājuši ar politiķiem, rakstījuši nostājas dokumentus – un turpinām cīnīties par praktiskāku pielietojumu. Piemēram, kāpēc ir nepieciešama papīra lietošanas instrukcija visās ES valodās katram vienreizējas lietošanas skalpelim? Es varu arī iztēloties, ka daži uzņēmumi, lai apietu MDR, vispirms savas inovatīvās ierīces ieviesīs ASV vai Ķīnā. Bet MDR jebkurā gadījumā ir viena priekšrocība: reģiona uzņēmumu sadarbība ir ievērojami uzlabojusies. Ir mazāka konkurence un lielāka sadarbība. Tas varētu novest pie kaut kā jauna.“
7. stacija: Cilvēkfaktors
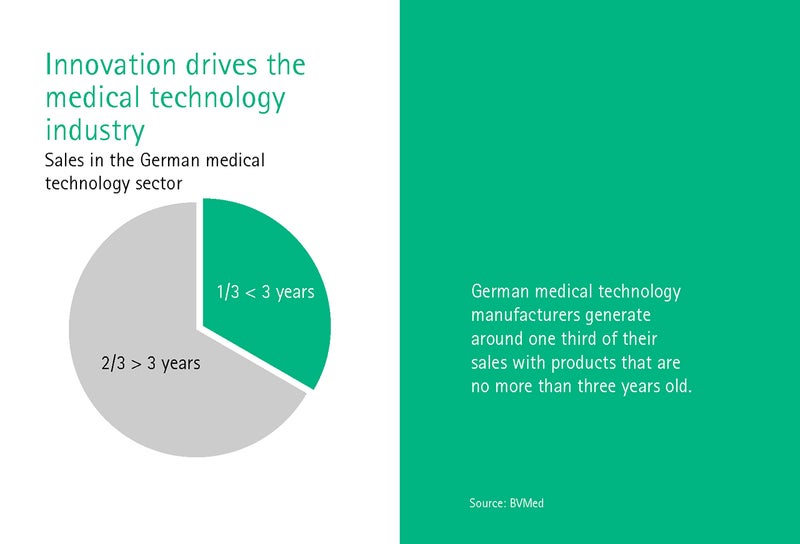
Dr. Džovanni Rubē strādā Heidelbergas Universitātes Medicīnas vēstures un ētikas institūtā un galvenokārt nodarbojas ar digitālās transformācijas ētiskajiem aspektiem. Kā būtu jāizskatās tiesiskajam regulējumam, kas iet kopsolī ar pārmaiņām, vaicā Rubē? Galu galā medicīnas tehnoloģiju nozare nodrošina trešo daļu no apgrozījuma ar ierīcēm, kas nav vecākas par trim gadiem.
„Veselības aprūpes sistēma strauji mainās: piemēram, pašlaik ir lejupielādējamas 10 000 psihoterapijas lietotņu. Bet vai tās tiešām ir medicīnas ierīces? Un kā tiek klasificētas un regulētas jaunās AI lietojumprogrammas, kuras pirms dažiem gadiem šķita neiedomājamas? Ekonomika zināšanas pārvērš ierīcēs tik ātri, ka likumdevējs diez vai var izsekot līdzi. Arī tehnoloģiskās transformācijas pārbaudīs MDR. Pacienta interese ir ļoti skaidra: ierīcei ir man jāpalīdz. Un tai jābūt drošai. Tāpēc no ētikas viedokļa ir apsveicami, ka normatīvais regulējums ir palicis stingrāks un skaidrāks. Kas liek man domāt, ka papildu izdevumi būtu jāsedz ar līdzīgiem resursiem un personāla līmeni. Nepietiek ar likuma pieņemšanu. Jānodrošina arī atbilstoša infrastruktūra un resursi. MDR ir ļoti sarežģīta lieta. Un tā ir arī ētiska problēma. Jo pacientiem un pat medicīnas profesionāļiem nav viegli tajā orientēties. Ir taisnība, ka visai informācijai jābūt pieejamai EUDAMED datu bāzē. Bet tā nebūs gatava līdz 2024. gadam un galvenokārt ir paredzēta ekspertiem. Protams, lielākā daļa cilvēku uzticas savam ārstam. Bet ar regulu vien nepietiek, lai palielinātu zaudēto uzticību medicīnas ierīču nozarei. Politikai un biznesam ir jāapsver, kā komunicēt ar pacientiem, un jāsniedz visa informācija, kas nepieciešama lēmuma pieņemšanai pašiem.“